XORTX Therapeutics vor großen Schritten: FDA gibt grünes Licht für nächstes Stadium in der Gichtbehandlung
XORTX Therapeutics, ein kanadisches Pharmaunternehmen spezialisiert auf die späten Stadien klinischer Studien, hat von der US-amerikanischen Arzneimittelbehörde FDA richtungsweisende Rückmeldungen zu ihrem Zulassungsantrag für ein neues Gichtmedikament erhalten. Die auf dem Typ-B-Meeting der FDA diskutierten Punkte ebnen den Weg für die Einreichung eines NDA-Zulassungsantrags für eine innovative Oxypurinol-Formulierung namens XORLOTM.
Der nächste Fahrplan für XORTX beinhaltet die Zusammenstellung eines detaillierten Sitzungsprotokolls, Einreichungen von Anträgen für Studien neuer Arzneimittel und die umfassende Untersuchung der Pharmakokinetik ihrer neuen Tablettenform. Darüber hinaus werden Fertigungskapazitäten für das Medikament evaluiert, um alle Anforderungen des Zulassungsverfahrens zu erfüllen.
Man rechnet mit einer vollständigen Einreichung des Antrags Ende des ersten Halbjahres 2026. Dr. Allen Davidoff, CEO von XORTX, sieht in der FDA-Rückmeldung die Möglichkeit, dringend benötigte Therapiemöglichkeiten für Patienten mit Gicht weiterzuentwickeln.
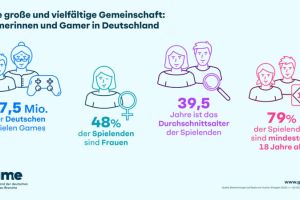
In den USA betrifft die Gicht, eine schmerzhafte Form der Arthritis, etwa 9,2 Millionen Menschen. Durch innovative Arzneimittel wie XORLOTM könnte eine Linderung für Patienten erreicht werden, die herkömmliche Behandlungen nicht vertragen.
XORTX bleibt auch bei weiteren Indikationen aktiv und entwickelt Produkte, die den Purinstoffwechsel beeinflussen, um die Produktion von Harnsäure zu verringern.